Monografía del Producto
Departamento Médico y Regulatorio
1. NOMBRE DEL MEDICAMENTO
Azitromicina 200 mg/5 ml polvo para suspensión oral
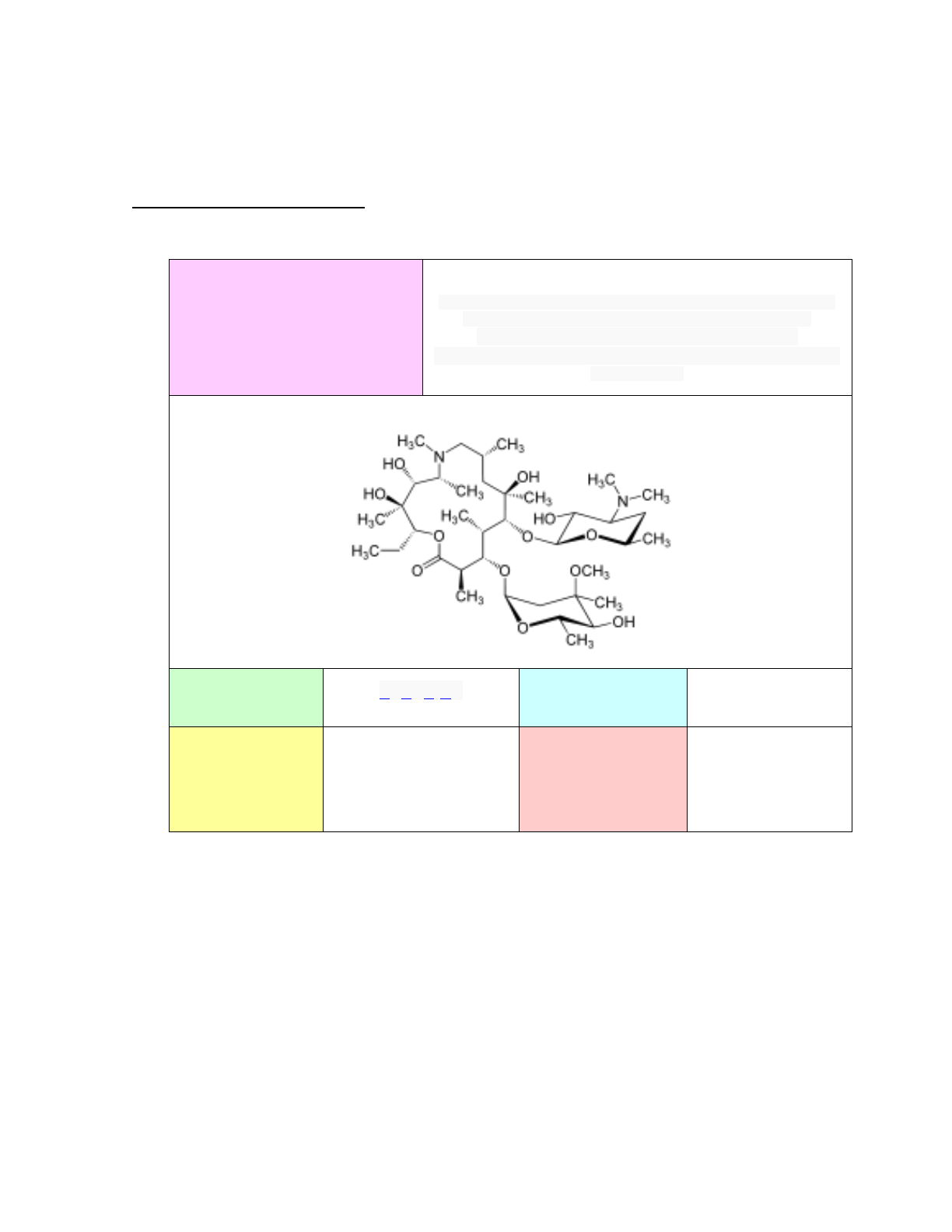
QUÍMICA DEL PRINCIPIO ACTIVO
Nombre químico
(2R,3S,4R,5R,8R,10R,11R,12S,13S,14R)-2-ethyl-3,4,10-trihydroxy-
3,5,6,8,10,12,14-heptamethyl-15-oxo- 11-{[3,4,6-trideoxy-3-
(dimethylamino)-
β-D-xylo-hexopyranosyl]oxy}-1-oxa-6-
azacyclopentadec-13-yl 2,6-dideoxy-3-C-methyl-3-O-methyl-
α-L-ribo-
hexopyranoside
Fórmula
Peso Molecular
[g/mol]
748.984
Número CAS
83905-01-5
Código ATC
J01FA10 – S01AA26
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada 5ml de suspensión oral preparada contiene:
Azitromicina.................................................200mg
Excipientes......................................................c.s.p.
Excipientes del polvo de azitromicina: sacarosa, sodio fosfato tribásico anhidro, goma xantano,
sacarina sódica, almidón pregelatinizado, hidroxipropilmetilcelulosa, saborizante de cereza,
saborizante de vainilla y saborizante de banano.
Excipientes del disolvente: sorbitol 70%, propilenglicol, metilparabeno, propilparabeno y agua
desionizada.